- Հեղինակ Alex Aldridge [email protected].
- Public 2023-12-17 13:41.
- Վերջին փոփոխված 2025-06-01 07:36.
Առաջին և երկրորդ կարգի ռեակցիաների հիմնական տարբերությունն այն է, որ առաջին կարգի ռեակցիաների արագությունը կախված է արագության հավասարման մեջ ռեակտիվ նյութի կոնցենտրացիայի առաջին հզորությունից, մինչդեռ երկրորդ կարգի ռեակցիաների արագությունը կախված է կոնցենտրացիայի երկրորդ հզորությունից: ժամկետը փոխարժեքի հավասարման մեջ։
Ռեակցիայի կարգը այն հզորությունների գումարն է, որին բարձրացված են ռեակտիվների կոնցենտրացիաները արագության օրենքի հավասարման մեջ: Այս սահմանման համաձայն կան ռեակցիաների մի քանի ձևեր. զրոյական կարգի ռեակցիաներ (այս ռեակցիաները կախված չեն ռեակտիվների կոնցենտրացիայից), առաջին կարգի ռեակցիաներ և երկրորդ կարգի ռեակցիաներ։
Ի՞նչ են առաջին կարգի ռեակցիաները:
Առաջին կարգի ռեակցիաները քիմիական ռեակցիաներ են, որոնց ռեակցիայի արագությունը կախված է ռեակցիայի մեջ ներգրավված ռեակտիվներից մեկի մոլային կոնցենտրացիայից: Հետևաբար, ռեակցիայի կարգի վերը նշված սահմանման համաձայն, այն հզորությունների գումարը, որոնց նկատմամբ ռեակտիվների կոնցենտրացիաները բարձրացվում են արագության օրենքի հավասարման մեջ, միշտ կլինի 1: Կարող է լինել կամ մեկ ռեակտիվ, որը մասնակցում է այդ ռեակցիաներին: Այնուհետև այդ ռեակտիվ նյութի կոնցենտրացիան որոշում է ռեակցիայի արագությունը։ Բայց երբեմն կան մեկից ավելի ռեակտիվներ, որոնք մասնակցում են այս ռեակցիաներին, ապա այդ ռեակտիվներից մեկը կորոշի ռեակցիայի արագությունը:
Եկեք դիտարկենք մի օրինակ այս հասկացությունը հասկանալու համար: N2O5-ի տարրալուծման ռեակցիայում այն ձևավորում է NO2 և O 2 գազեր որպես արտադրանք: Քանի որ այն ունի միայն մեկ ռեակտիվ, մենք կարող ենք գրել ռեակցիան և արագության հավասարումը հետևյալ կերպ։
2N2O5(g) → 4NO2(g) + O 2(g)
Rate=k[N2O5(g)]մ
Այստեղ k-ն այս ռեակցիայի արագության հաստատունն է, իսկ m-ը ռեակցիայի կարգն է: Հետևաբար, փորձարարական որոշումներից m-ի արժեքը 1 է: Այսպիսով, սա առաջին կարգի ռեակցիա է:
Ի՞նչ են երկրորդ կարգի ռեակցիաները:
Երկրորդ կարգի ռեակցիաները քիմիական ռեակցիաներ են, որոնց ռեակցիայի արագությունը կախված է ռեակտիվներից երկուսի մոլային կոնցենտրացիայից կամ ռեակցիայի մեջ ներգրավված մեկ ռեակտիվի երկրորդ հզորությունից: Հետևաբար, ըստ ռեակցիայի կարգի վերը նշված սահմանման, այն հզորությունների գումարը, որոնց նկատմամբ ռեակտիվների կոնցենտրացիաները բարձրացվում են արագության օրենքի հավասարման մեջ, միշտ կլինի 2: Եթե կան երկու ռեակտիվներ, ռեակցիայի արագությունը կախված կլինի առաջին հզորությունից: յուրաքանչյուր ռեակտիվ նյութի կոնցենտրացիան:
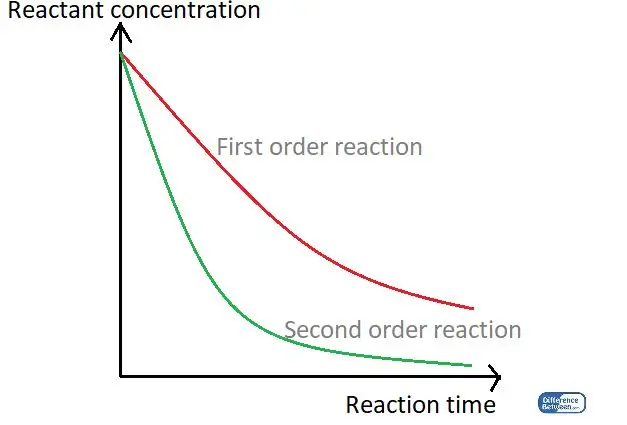
Գծապատկեր 01. Գրաֆիկ, որը համեմատում է ռեակցիաների կարգի երկու տեսակները՝ օգտագործելով դրանց արձագանքման ժամանակը և ռեակտիվ նյութի կոնցենտրացիան:
Եթե ռեակտիվ նյութի կոնցենտրացիան ավելացնենք 2 անգամ (եթե արագության հավասարման մեջ կա երկու ռեակտիվ), ապա ռեակցիայի արագությունը մեծանում է 4 անգամ։ Օրինակ, եկեք դիտարկենք հետևյալ արձագանքը։
2A → P
Այստեղ A-ն ռեակտիվ է, իսկ P-ն արտադրանքն է: Եթե սա երկրորդ կարգի ռեակցիա է, ապա այս ռեակցիայի արագության հավասարումը հետևյալն է։
Rate=k[A]2
Բայց երկու տարբեր ռեակտիվներով ռեակցիայի համար, ինչպիսիք են՝
A + B → P
Գնահատական =k[A]1[B]1
Ո՞րն է տարբերությունը առաջին և երկրորդ կարգի ռեակցիաների միջև:
Առաջին կարգի ռեակցիաները քիմիական ռեակցիաներ են, որոնց ռեակցիայի արագությունը կախված է ռեակցիայի մեջ ներգրավված ռեակտիվներից մեկի մոլային կոնցենտրացիայից:Հետևաբար, եթե ռեակտիվ նյութի կոնցենտրացիան ավելացնում ենք 2 անգամ, ռեակցիայի արագությունը մեծանում է 2 անգամ։ Երկրորդ կարգի ռեակցիաները քիմիական ռեակցիաներ են, որոնց ռեակցիայի արագությունը կախված է ռեակտիվներից երկուսի մոլային կոնցենտրացիայից կամ ռեակցիայի մեջ ներգրավված մեկ ռեակտիվ նյութի երկրորդ հզորությունից: Այսպիսով, եթե ռեակտիվ նյութի կոնցենտրացիան ավելացնենք 2 անգամ, ռեակցիայի արագությունը կմեծանա 4 անգամ։ Ստորև բերված ինֆոգրաֆիկան ներկայացնում է առաջին և երկրորդ կարգի ռեակցիաների տարբերությունը աղյուսակային տեսքով:

Ամփոփում - Առաջին ընդդեմ երկրորդ կարգի ռեակցիաներ
Կա ռեակցիաների երեք հիմնական տեսակ՝ ըստ ռեակցիայի հերթականության. զրոյական կարգի, առաջին կարգի և երկրորդ կարգի ռեակցիաներ: Առաջին և երկրորդ կարգի ռեակցիաների հիմնական տարբերությունն այն է, որ առաջին կարգի ռեակցիայի արագությունը կախված է արագության հավասարման մեջ ռեակտիվ նյութի կոնցենտրացիայի առաջին հզորությունից, մինչդեռ երկրորդ կարգի ռեակցիայի արագությունը կախված է համակենտրոնացման տերմինի երկրորդ ուժից: տոկոսադրույքի հավասարումը.






